近年來,不少湖泊、水庫水體都存在不同程度的富營養化現象。富營養化水體爆發“水華”現象帶來的藻類大量繁殖使水質惡化,嚴重威脅著飲用水水質的安全和人類的健康。銅綠微囊藻(microcystisaeruginosa)作為最常見的藍藻之一,是我國富營養化水體中最具生長優勢的藻種。由于藻類具有密度小、電動電位低等特點,可以穩定存在于水中,去除藻類難度較大,嚴重影響了水處理的效率。目前藻類去除方法主要包括物理法、化學法和生物法3類,混凝是最為常見的化學除藻方法之一。
原水水質是影響混凝效率的主要因素之一。原水中包含的天然有機物(naturalorganicmatter,NOM)主要由2部分構成,一類是腐殖質包括腐殖酸、富里酸等,大約占水中溶解性有機物50%以上,其中腐殖酸占腐殖質總量的50%~80%;另一類是非腐殖質,如蛋白質、糖類、木質素等,大概占有機質總量的20%~40%。NOM的質量濃度和化學組成會影響混凝效率和混凝后絮體形態。腐殖酸和蛋白質常被當作典型NOM物質來進行研究。在含藻水體中,水中NOM會與藻類有機物搶奪混凝劑,從而影響混凝效果及絮體的形成。KIM等和CHOW等研究發現混凝工藝中,疏水性的有機物較親水性有機物更易被去除。MATILAINEN等研究發現鐵鹽或鋁鐵混合鹽能去除95%的大分子有機物,而僅有10%的相對分子質量小于1kDa的小分子有機物能被去除。雷青等研究發現腐殖酸較富里酸更容易被混凝藥劑去除,水中腐殖酸和富里酸質量濃度較大時會影響水中藻細胞的去除。劉艷靜探究了腐殖酸和牛血清蛋白對混凝效果和出水余鋁的影響。蘇航等探究了水中有機物對混凝的影響及無機絮凝劑的使用。但目前較少有文獻研究NOM存在時對藻類混凝效果的影響。
以含銅綠微囊藻的水體作為研究對象,以牛血清蛋白(BSA)和腐殖酸(HA)為NOM的代表物,通過改變BSA與HA的投加量來調節水中有機物質量濃度,探究了有機物種類和質量濃度對含藻水體混凝效果的影響,結合水體有機物去除和絮體形成特征進一步分析影響機理。并探究不同水質下較優混凝藥劑投加量,以期為含不同有機物源水或源水有機物含量波動狀況下混凝除藻工藝提供參考依據,優化混凝工況,保證出水水質。
1、材料與研究方法
1.1 實驗材料與試劑
銅綠微囊藻藻源購自中科院武漢水生生物研究所,取50mL藻種接種至120℃滅菌120min后的常溫BG11培養基中,并放入光照培養箱進行培養,配養條件設置為(25±1)℃、晝夜時間比為12h∶12h。取穩定期的藻類進行實驗。
本實驗采用慢速滴堿法制備的PACl作為混凝劑。實驗中應用的氯化鋁(AlCl3)、氫氧化鈉(NaOH)、牛血清蛋白(BSA)及腐殖酸(HA)試劑均為分析純。
1.2 試驗水樣配制
1)含藻水體的配制。為模擬藻類水華發生時水體中的藻類密度和質量濃度,以680nm處的吸光度作為參考值,控制混凝水體中藻類吸光度為0.06。此時藻類的密度約為2.83×106細胞數·mL−1,接近藻類水華的臨界點密度2.5×106細胞數·mL−1。通過添加5mmol·L−1的碳酸氫鈉和硝酸鈉來調節水體中的離子強度,使用氫氧化鈉和鹽酸調節水樣pH=7。
2)牛血清蛋白溶液配制。取1.0g的牛血清蛋白粉末,溶于500mL超純水中,連續攪拌5h后,使用0.45μm濾膜過濾,并在TOC標定之后,貯存于4℃的冰箱中保存,以備后用。
3)腐殖酸溶液配制。取1.0g干燥腐殖酸固體碾磨的微細粉末,將其加入0.5或0.01mol·L−1的NaOH溶液,連續攪拌5h至完全溶解,將其pH調節至12,用0.45μm膜過濾,儲存于500mL玻璃瓶中,并在TOC標定之后,避光儲存于4℃冰箱。
1.3 實驗方法
1)混凝實驗:使用混凝攪拌儀(MY3000-6F,武漢梅宇儀器有限公司)進行實驗,加入PACl混凝劑后以快速攪拌(200r·min−1,30s)處理促進混凝劑分散,再以慢速攪拌(40r·min−1,10min)處理促進絮體形成,最后靜置30min,取液面下1.5cm處的樣品,進行濁度和藻類吸光度檢測。
2)有機物質量濃度對藻類去除的影響實驗:制備好的BSA、HA用TOC進行標定,對含藻水體分別投加1、3和5mg·L−1(以DOC計算)的有機物,對配置好的水體進行混凝實驗,反應條件同混凝實驗一致,其中PAC投加量選取混凝實驗中各有機物質量濃度最大水體的最優混凝藥劑投加量,取液面下1.5cm處的樣品,進行三維熒光檢測。
3)絮體破碎與恢復實驗:本實驗反應條件同混凝實驗一致,在混凝實驗慢攪10min后,進行快速攪拌(200r·min−1,5min)的破碎,破碎后再進行慢速攪拌(40r·min−1、10min)對絮體進行恢復。上述實驗過程中,利用馬爾文粒度儀來測定混凝過程中絮體的粒徑變化,以D50代表絮體平均粒徑,通過絮體粒徑變化來考察其的密實程度。并在混凝實驗結束后對已經形成的絮體進行破碎再絮凝試驗,通過強度因子Sf和恢復因子Rf來考察絮體的恢復能力,見式(1)和式(2)。

式中:d1示混凝過程中絮體平均粒徑,μm;d2表示絮體破碎后的平均粒徑,μm;d3表示破碎再絮凝之后絮體的平均粒徑,μm。
1.4 分析方法
三維熒光光譜通過熒光強度來揭示水中有機污染物的種類及其質量濃度。本實驗通過熒光分光光度計(F-7000,日立),以氘燈為激發光源,設置發射波長Em=220~550nm,激發波長Ex=200~400nm,掃描速度為12000nm·min−1檢測水樣中的有機物。高效體積排阻色譜(HPSEC)主要測定水體中有機物的分子質量分布。本實驗通過高效體積液相色譜(Waters1525,上海馭锘實業有限公司),以5mol·L−1磷酸鹽(pH6.8)和0.01mol·L−1NaCl為流動相,采用0.22μm濾膜過濾和30min超聲脫氣,設置進樣量和進樣速率分別為600μL和0.8mL·min−1檢測水體中有機物分子質量分布。
采用濁度儀(2100N,美國哈希)測定水體濁度;采用紫外分光光度計(U-2910,日立),根據OD680nm處的吸光度來檢測藻細胞的去除率。其去除率見式(3)。

式中:R為藻細胞去除率,%;A1代表混凝處理前藻類在680nm處的吸光度;A2代表混凝處理后藻類在680nm處的吸光度。
2、結果與討論
2.1 有機物質量濃度對濁度和藻類去除的影響
為探究有機物種類、質量濃度對含藻水體混凝效果及混凝藥劑投加量的影響,分別考察含藻水在BSA和HA質量濃度為0~5mg·L−1、PACl投加量為0.02~0.12mmol·L−1條件下濁度和藻細胞去除效果,結果如圖1所示。
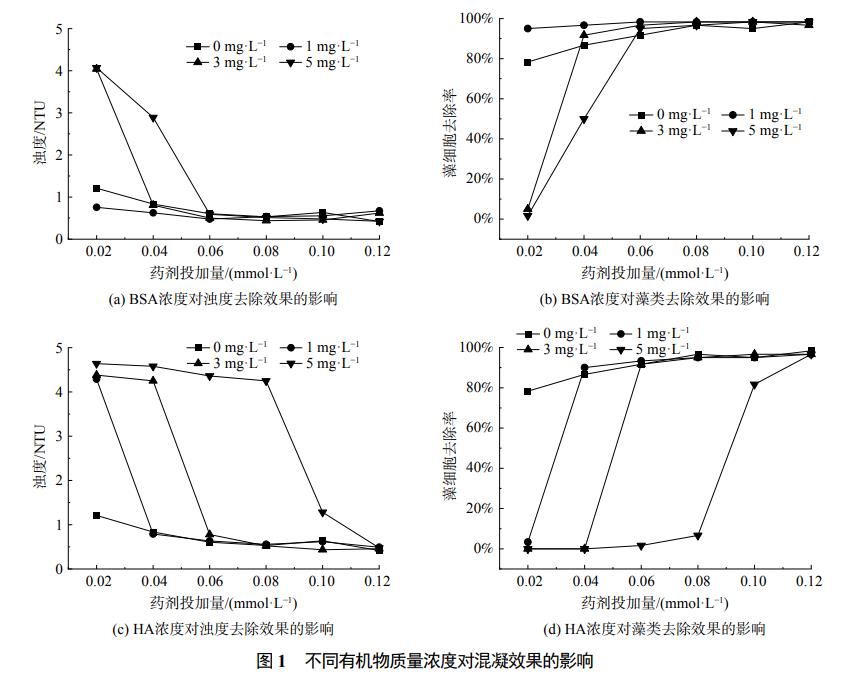
從圖1(a)與圖1(b)可以看出,BAS質量濃度較低時含藻水體混凝去除濁度及藻細胞效果更好。未投加BSA的含藻水體在PACl投加量為0.04mmol·L−1時,可以達到出水濁度小于1NTU、藻細胞去除率達到90%上的混凝效果。當BSA添加量為1mg·L−1時,僅需投加0.02mmol·L−1的PACl就能達到相同的混凝效果。投加1mg·L−1的BSA有利于混凝反應的進行,因為與未添加BSA的含藻水體達到相同混凝效果時,可節約50%的混凝藥劑投加量。這可能是因為BSA作為大分子有機物,可以通過提高絮體初始形成速率,進而增強混凝的吸附架橋和網捕卷掃作用,因此少量的BSA對混凝有促進作用。在此混凝劑投加量下,隨著水中BSA質量濃度的增加,混凝效果逐漸降低。BSA的添加量超過1mg·L−1的含藻水無法達到出水濁度小于1NTU、藻細胞去除率達到90%上的混凝效果。提高混凝藥劑投加量可有效緩解有機物質量濃度增加對混凝效果的影響。BSA添加量增加至5mg·L−1時,當混凝藥劑投加量增加到0.06mmol·L−1,亦能達到出水濁度低于1NTU、藻細胞去除率高于90%的混凝效果。但此時PACl的投加量較未添加BSA含藻水體的投藥量增加0.02mmol·L−1,不利于混凝反應的進行。這可能是因為大量的BSA添加會搶占混凝劑的活性位點,對含藻水體混凝效果產生負面影響,導致對混凝劑的需求量增大。
由圖1(c)和圖1(d)可以看出,HA阻礙含藻水體混凝反應的進行,在相同混凝藥劑投加量下,HA的添加量越大,混凝出水效果越差。未投加HA的含藻水體在PACl投加量為0.04mmol·L−1時,可以達到出水濁度小于1NTU、藻細胞去除率達到90%上的混凝效果。當HA添加量為1mg·L−1時,需投加0.06mmol·L−1的PACl才能達到相同的混凝效果。HA添加量進一步增加,達到5mg·L−1時,需投加0.12mmol·L−1的PACl才能達到相同的混凝效果,較未添加HA含藻水體的投藥量增加0.08mmol·L−1,可能是因為HA與Al(OH)3絮體的親和力較水中其他有機物更大。由于其表面電荷密度較其他有機物更大,HA先與PACl進行電中和作用,所以阻礙了混凝反應的進行。HA對含藻水體混凝效果的影響大于BSA對其的影響,在相同混凝條件下,相同添加量的HA、BSA水體達到出水濁度低于1NTU、藻細胞去除率高于90%的混凝效果,HA需要更高的混凝藥劑投加量。
2.2 有機物質量濃度對藻細胞去除的影響
熒光類有機物在水體有機物中質量分數達到60%~70%,因此通過三維熒光光譜可以判斷水體中有機物的分布情況。為更好地對水中有機物進行分析,CHEN等將激發波長(Ex)在200~400nm,發射波長(Em)在300~550nm區域內的熒光數據劃分為5個區域,代表5種不同有機物,Ⅰ區為類蛋白質I(Ex/Em=200~250/280~330nm)、Ⅱ區代表類蛋白質II(Ex/Em=200~250/330~380nm)、Ⅲ區代表富里酸(Ex/Em=200~250/380~550nm)、Ⅳ和Ⅴ區分別代表溶解性微生物代謝產物(SMP)(Ex/Em=250~280/280~380nm)和類腐殖酸(Ex/Em=250~400/380~550nm)。為對比添加BSA、HA物質含藻水體與含藻水體中有機物含量的差別,進而分析水中有機物對混凝效果的影響,對含藻水體、添加BSA和HA的含藻水體進行有機物檢測,3種水體三維熒光表征結果如圖2(a)~圖2(c)所示。由圖2(a)可知,含藻水體主要包含富里酸、少量SMP和腐殖酸類有機物。這符合吳昊瀾等研究結果,含藻水體有機物主要來源于銅綠微囊藻胞外有機物。由圖2(b)中可以看出,加入BSA的藻液相較于單獨藻液,SMP(Ex/Em=260~280/280~320nm)、腐殖酸(Ex/Em=250~270/420~480nm)峰強增加。在蛋白區域增加了一個吸收峰(Ex/Em=220~250/280~350nm)包括酪氨酸類蛋白和色氨酸類蛋白,富里酸強度略有上升。由圖2(c)可知,較單獨藻液而言,加入HA的藻液中,腐殖酸(Ex/Em=250~280/380~500nm)、富里酸(Ex/Em=230~250/380~500nm)的吸收峰大大增強。此外出現了2個新的吸收峰(Ex/Em=220~280/280~330nm和Ex/Em=220~280/330~400nm),可能為蛋白質類物質。
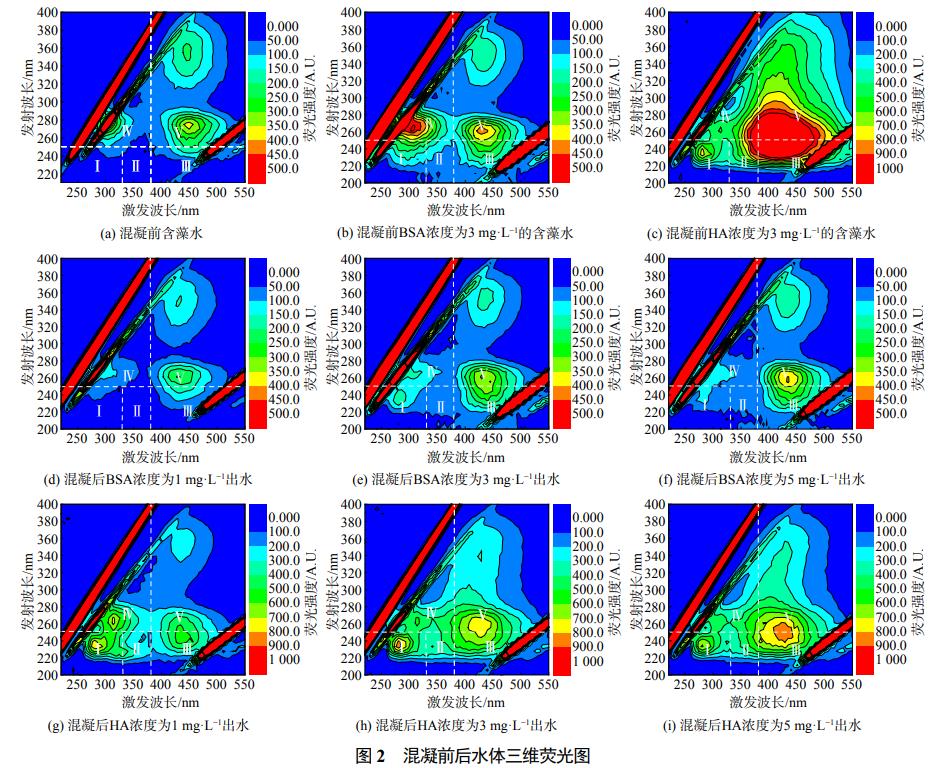
為探究有機物對含藻水體混凝效果的影響,在BSA添加量為1~5mg·L−1時,取混凝藥劑為0.06mmol·L−1混凝處理后的上清液進行檢測;在HA投加量為1~5mg·L−1時,取混凝藥劑為0.12mmol·L−1混凝處理后的上清液進行檢測,觀察有機物去除情況。由圖2(d)~圖2(f)可以看出,在混凝過程中,對激發波長在280~350nm,發射波長在220~280nm間的蛋白峰存在去除效果。在BSA質量濃度為1~5mg·L−1時,均可達到較好蛋白峰的去除效果,在BSA質量濃度為1mg·L−1時,蛋白峰近乎完全去除。研究結果同馬敏等一致,芳香度較高的蛋白類有機物優先在混凝中被鋁鹽去除。而對腐殖酸(Ex/Em=250~280/400~480nm)和富里酸(Ex/Em=220~250/400~480nm)去除效果相對較差。且隨著BSA質量濃度的增加,有機物去除效果越差。由圖2(g)~圖2(f)可以看出,混凝后腐殖酸(Ex/Em=250~280/380~500nm)、富里酸(Ex/Em=230~250/380~500nm)的吸收峰明顯減弱。相對于腐殖酸、富里酸而言,SMP(Ex/Em=250~280/280~380nm)、蛋白類物質(Ex/Em=200~250/280~380nm)去除效果明顯減弱,說明混凝對腐殖酸和富里酸去除效果較好。但隨著水體中HA質量濃度的增加,腐殖酸吸收峰被去除的程度降低。
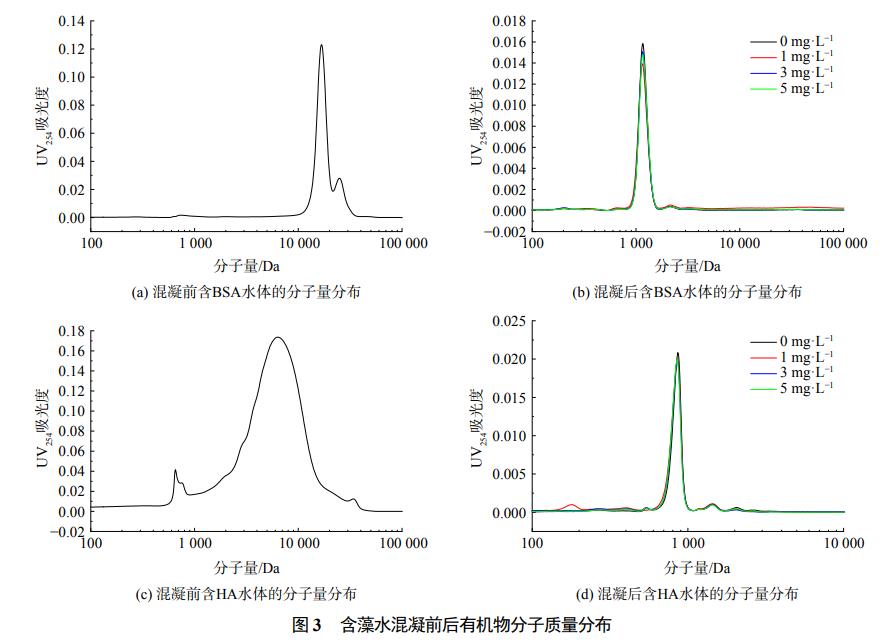
為進一步探究有機物種類及質量濃度對含藻水體混凝效果的影響,采用高效體積排阻色譜分析混凝前后水體有機物的分子質量分布情況。選取BSA、HA添加量為3mg·L−1的水體作為混凝前水體代表,對BSA添加量為1~5mg·L−1、PACl投加量為0.06mmol·L−1,HA添加量為1~5mg·L−1,PACl投加量為0.12mmol·L−1兩種情況下混凝沉后水進行分析。從圖3(a)中可看出,BSA在表觀分子約為10kDa處有1個強峰,在表觀分子質量約為30kDa處出現次強峰。圖3(c)分析了不同BSA質量濃度水體混凝后上清液中分子質量分布,可以看出,HA在表觀分子1kDa到30kDa均有分布,峰值出現在靠近10kDa處。對比可得,BSA的分子分布量相對較大,HA的分子分布量范圍較廣。圖3(b)表示混凝后的分子質量分布,可以看出10kDa處蛋白質類大分子有機物基本去除,此時僅在表觀分子為1kDa處剩下1個峰,BSA被完全去除。結合圖2(d)~圖2(f)可也以看出,含藻水添加了BSA后,藻類有機物基本沒有被去除。這可能是因為鋁鹽作為混凝劑主要去除大分子有機物,其他成分則較難去除。圖3(d)分析了不同HA質量濃度水體混凝后上清液的分子質量分布,可以看出,混凝后的表觀分子僅在1kDa處剩下1個峰,1kDa~30kDa處的有機物均被去除,即大量的HA在混凝過程中被去除。結合圖2(g)~圖2(i)可知,混凝對大分子的腐殖酸去除效果較好。SMP、蛋白區未被去除的可能為小分子親水性物質,推測為藻類小分子有機物。因為混凝主要去除大于3kDa的有機物,而藻類有機物分子質量主要為1kDa,小于等于1kDa處的小分子有機物大部分是親水性有機物,混凝對其物理吸附作用較弱。
2.3 有機物質量濃度對絮體形成的影響
根據徐磊等的研究,有機物通過改變絮體間靜電作用力和水合層間的厚度來影響絮體顆粒的特性。因此,研究添加不同種類、不同質量濃度有機物的含藻水體在混凝反應過程中絮體結構的變化是十分必要的。其處理過程絮體粒徑及強度變化見圖4、圖5。
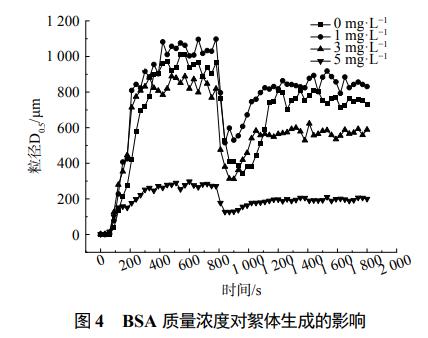
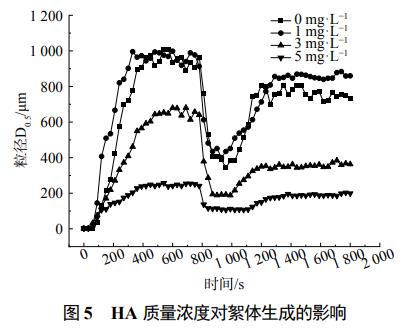
由圖4所示,不添加BSA的水體,混凝反應進行100s左右時,溶液中產生了粒徑約為20μm的絮體,隨著反應進行,約在400s時,絮體達到平衡,此時絮體粒徑增大到1010μm。破碎再絮凝之后,絮體粒徑達到穩定約需要400s,此時絮體粒徑約為880μm。水中BSA質量濃度為1mg·L−1的水體,絮體平均粒徑達到了1100μm,破碎再絮凝后的絮體粒徑也能達到900μm左右,并且其再次穩定的時間縮短至200s。水體中BSA質量濃度增大到3~5mg·L−1,混凝形成的絮體和破碎再絮凝形成的絮體粒徑有所減小,分別是880、620、290和200μm,但再次穩定時間依然較少,約為200s和400s。這表明少量的BSA有助于絮體的形成,過量的BSA則會影響含藻水體的混凝效果。表1中的強度因子可以證明,越密實的絮體結構,其強度因子越大,BSA質量濃度為1mg·L−1的絮體強度因子達到了62.69%,隨著BSA質量濃度的增加,絮體強度因子有所減小,但仍高于未添加BSA水體的絮體強度因子47.94%。分形維數也是確定絮體強度的一個指標,分形維數越低,絮體結構越分散。BSA質量濃度為1mg·L−1的絮體分形維數為2.03,大于未添加BSA水體的絮體分形維數1.86,而BSA質量濃度為3~5mg·L−1的水體中絮體恢復因子分別為47.98%和51.01%,均低于含藻水體中絮體的恢復因子55.09%。形成這種現象的原因主要是少量的BSA有助于增強吸附架橋作用,從而使絮體粒徑更大、穩定性更高,而大量的BSA會增加水中污染物,與混凝劑進行電中和作用,從而使得絮體粒徑減小,恢復性降低。
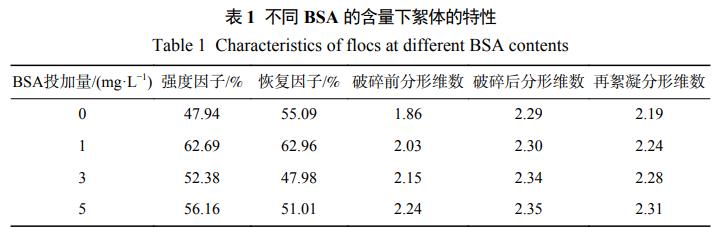
由圖5可知,當絮體粒徑達到穩定時,含藻水體中絮體的平均粒徑可達到1000μm,HA投加量為1mg·L−1時對混凝的效果影響并不明顯,絮凝速率有少量提升,絮體平均粒徑也可達到1000μm。隨著HA投加量的增加,含藻水體混凝效果逐漸變差,絮凝速率明顯降低,絮體平均粒徑降低到700μm和220μm。破碎再絮凝后,含藻水體的絮體平均粒徑下降到800μm。HA投加量為1mg·L−1時絮體平均粒徑有所下降,但略大于含藻水體,達到900μm。隨著HA投加量的增加,再絮凝的絮體平均粒徑降低到380μm和190μm。這表明大量的HA會影響含藻水體混凝效果。絮體的強度因子、恢復因子測定結果如表2所示。HA投加量為1mg·L−1時,水體中絮體的強度因子(50.10%)和恢復因子(73.75%)均高于含藻水體中絮體的數值(47.94%、62.96%)。隨著HA投加量的增加,水中絮體的強度因子(35.4%、44.72%)、恢復因子(53.68%、30.29%)呈現降低趨勢,破碎再絮凝能力持續減弱。這可能是因為混凝體系形成絮體不僅僅依靠電中和形成的物理鍵,還依靠化學鍵的形成。表2還分析了不同HA投加量下絮體分形維數的變化,絮體分形維數隨著HA的投加量的增加呈現先增加后降低的變化趨勢。這表明大量的HA會使絮體的結構更加松散,可能是HA上的官能團同混凝劑上的有效結合點進行結合,減少了有效結合點,導致絮體結構不夠緊實。
3、結論
1)少量的BSA對混凝反應起促進作用,當BSA的添加量超過1mg·L−1時轉為抑制作用。當BSA添加量為1mg·L−1時,僅需投加0.02mmol·L−1的PACl就能跟投加0.04mmol·L−1PACl的未添加BSA的含藻水體達到相同的混凝效果。隨著BSA添加量的增加,PACl的投加量逐漸超過含藻水的PACl投加量。可能是因為隨著BSA添加量的增加,電中和作用成為主要的反應機理,BSA搶占了混凝活性位點,阻礙混凝反應進行。
2)HA不利于混凝反應的進行。當HA添加量為1mg·L−1時,需投加0.06mmol·L−1的PACl才能跟投加0.04mmol·L−1PACl的未添加HA的含藻水體達到相同的混凝效果。隨著HA添加量的增加,PACl的需求投加量也逐漸提高。可能是因為HA中的官能團優先與混凝劑結合,從而導致混凝效果變差。
3)BSA、HA對混凝效果的影響主要體現在對水中有機物的去除。BSA、HA等大分子有機物先與混凝劑進行反應,可以較好的被去除,而剩余親水性小分子有機物難以被去除,如藻類有機物。并且,少量的BSA、HA均有利于混凝絮體的形成,有利于絮體沉降。(來源:沈陽環境科學研究院,華北電力大學)



